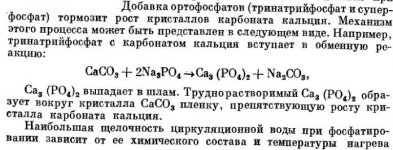Накипеобразование.
Накипеобразование - представляет собой сложный процесс кристаллизации, одним из условий которого является пересыщенное состояние-раствора, возникающее вследствие тепловых процессов.Образование центров кристаллизации более интенсивно протекает в пристенном слое из-за большей концентрации солей, которая здесь достигается вследствие более интенсивного парообразования.
В результате адгезионных и электростатических процессов, возникающих между частицей и поверхностью металла, образуются кристаллические ядра - основа будущей накипи.
Накипеобразование в циркуляционной системе охлаждения вызывается в основном распадом бикарбонатов кальция Ca(HCO3)2 (гидрокарбонат кальция Бикарбонат кальция, кислый углекислый кальций, двууглекислый кальций). Образующиеся при этом частички углекислого кальция проходят несколько ступеней роста: от размеров молекулы до кристалла при выпадении из воды.
Время, необходимое для возникновения кристалла, осаждающегося на поверхности нагрева, имеет большое значение при накипеобразовании.
Накипь – это твёрдые отложения солей жёсткости, которые формируются, главным образом, структурами кристаллов карбоната кальция (CaCO3).
Соли жёсткости - ионы кальция (Ca2+), магния (Mg2+) и бикарбоната (HCO3-) - попадают в систему водоснабжения в растворенном виде из грунтовых вод и известняковых артезианских скважин, что обуславливает наличие жёсткой воды в системе водоснабжения практически всех географических поясов России.
Жесткость воды — это ее свойство, зависящее от наличия в ней, главным образом, растворенных солей кальция и магния. Суммарное содержание этих солей называют общей жесткостью.
Общая жесткость воды образуется из двух составляющих: Жесткость карбонатная + Жесткость некарбонатная.
Карбонатной (временной) (устранимой) жесткости – обуславливается присутствием в воде бикарбонатов кальция и магния Са(НСО3)2 или Мg(НСО3)2
При кипячении воды гидрокарбонаты разлагаются, образуя очень плохо растворимый карбонат кальция, углекислый газ и воду:
Если содержание в воде ионов НСО3- меньше Са и Мg, то величина временной (карбонатной) жесткости равна концентрации НСО3-.
Если содержание в воде ионов НСО3- больше Са и Мg, то величина временной (карбонатной) жесткости равна сумме содержания Са и Мg или равно Жесткости общей.
Некарбонатная (постоянная) жесткость - обусловленна концентрацией в воде хлоридов, сульфатов и некарбонатных солей кальция и магния, и ее значение нельзя уменьшить (сохраняющаяся в воде после кипячения).
Термостабильность воды
Данная величина оценивается по относительной скорости отложений на индикаторных пластинках выполненных из металла аналогичному металлу теплообменного оборудования.По разности в весе пластин экспанируемых в исследуемой воде и высушенных до сухого состояния в течении 48 часов.
Определяется скорость отложений весовая по формуле Со =(М2-М1)/(F*T), где
М2 – вес пластины после экспозиции
М1 – вес пластины до экспозиции
F – площадь поверхности пластины м2
T – время экспозиции пластины в часах
и линейная по формуле
где
Полученные результаты сравнивают с таблицей термостабильной воды

Умягчение воды известью
Метод заключается в связывании гашеной известью (Ca(OH)2) растворенной в воде углекислоты с образованием карбонатных ионов и переводе солей жесткости Са и Мg в малорастворимые соединения CaCO3↓ и гидрата окиси магния.
Процесс известкования:
1) Вводим известь: CaO+H2O=Ca(OH)2;
2) Связывание свободного углекислого газа: CO2+Ca(OH)2=CaCO3+H2O;
3) Снижение карбонатной жесткости:
Ca(HCO3)2+Ca(OH)2=2CaCO3(ос)+2H2O;
Mg(HCO3)2+2Ca(OH)2=Mg(OH)2(ос)+2CaCO3(ос)+2H2O;
Доза извести для перевода карбонатной жесткости добавочной воды в малорастворимый углекислый кальций высчитывается по формуле.
Ди = 28 * ((СО2/22)+(НСО3-/61)+(доза коагул/эквивал. Вес актив вещества коаг)+0,5)*(100/содержание СаО в извести в %)=мг/л
Ингибиторы накипеобразования
Натриевая соль оксипропилен диамина тетраметилен тетра фосфоновой кислоты = Высокоэффективный органический ингибитор накипеобразования. Предназначен для работы в оборотных системах с содержанием кальция до 20 мг-экв/дм3, при высокой щелочности от 6 мг-экв/дм3 до 10 мг-экв/дм3.- 2-фосфоно-бутан-1,2,4-трикарбоновая кислота (РВТС) = органические фосфонаты = применяется и как ингибитор коррозии и как ингибитор накипеобразования.
-прекрасная устойчивость по отношению к активному хлору и другим окислителям -исключительная растворимость в щелочах с высокой концентрацией. Рекомендации по применению -в чистящих и моющих средствах -для стабилизации отбеливающих реагентов -для обработки охлаждающей жидкости. Технические свойства группы продуктов РВТС -Ингибирование осаждения CaCo3: отлично -Ингибирование осаждения CaSo4: очень хорошо -Комплексирование ионов металла: хорошо -Ингибирование коррозии у нелегированных сталей: хорошо
1-Гидроксиэтилиден-1.1-Дифосфоновая кислота (HEDP) = О́ксиэтилиде́ндифосфо́новая кислота́ (ОЭДФ)
Кислота ОЭДФ представляет собой ингибитор коррозии органофосфорной кислоты. Может образовывать хелатные соединения с ионами железа (Fe), меди (Cu) и цинка (Zn). Может растворять оксидированные (окисленные) материалы на поверхностях этих металлов. ОЭДФ является прекрасным ингибитором накипеобразования и коррозии при температуре не выше 250°C. ОЭДФ обладает хорошей химической устойчивостью при высоком значении pH, тяжело гидролизируется, а также тяжело разлагается при обычных световых и тепловых условиях. Ее устойчивость к окислению кислота/щелочь и хлор лучше, чем у других органофосфорных кислот (соль). ОЭДФ может вступать в реакцию с ионами металла в системе водоснабжения для образования хелатного комплекса с гекса-элементом, в частности с ионом кальция. Следовательно, ОЭДФ обладает отличными свойствами, препятствующими образованию накипи. Хорошо взаимодействует с другими химическими средствами для водоподготовки.
В твердом состоянии ОЭДФ представляет собой кристаллический порошок, подходящий для использования в условиях низких температур. Благодаря высокой степени чистоты, может использоваться в качестве моющего средства (осветлителя) в области электроники и в качестве добавок к химическим средствам повседневного пользования.
Амино триметилен фосфоновая кислота (ATMP) = ATMP является ингибитором коррозии и образования отложений на основе фосфоната для оборудования или трубопроводов. Данная кислота часто связывается с другой органической кислотой, поли-карбоновой кислотой или ее солью с образованием органического агента для обработки воды. Агент используется в системах циркуляции охлаждающей воды в различных условиях. Он идеально подходит для систем водяного охлаждения и систем закачки воды на электростанциях и нефтеперерабатывающих заводах. Предпочтительной является доза 1-20 мг/л. При использовании в качестве антикоррозионного агента, вещество дозируется 20-60 мг/л.
Гексометилендиамин тетрауксусная кислота (метиленфосфоновая кислота) HMDTMPA
HMDTMPA может ингибировать образование различных отложений, таких как карбонат кальция, сульфат кальция, сульфат бария, оксид железа и др. Однако обычно данный агент используется в качестве ингибитора образования отложений сульфата кальция и сульфат бария в области очистки воды.
В различных органических фосфоновых кислотах, HMDTMPA с повышенной эффективностью на более долгий срок ингибирует отложение сульфата кальция. Таким образом, он особенно подходит для процесса экструзии на нефтяных месторождениях. Он также может быть использован для обработки котловой воды.
Добавка ортофосфатов (тринатрийфосфат и суперфосфат) тормозит рост кристаллов карбоната кальция. Механизм этого процесса может быть представлен в следующем виде. Например, тринатрийфосфат с карбонатом кальция вступает в обменную реакцию:
СаСО3 + 2Na,PO4 ->Са3 (РО4)2 + Na2CO3,
Са3 (РО4)2 выпадает в шлам. Труднорастворимый Са3 (РО4)2 образует вокруг кристалла СаСО3 пленку, препятствующую росту кристалла карбоната кальция.
Наибольшая щелочность циркуляционной воды при фосфатировании зависит от ее химического состава и температуры нагрева.
Цветение воды или биообрастание.
В системах оборотного водоснабжения биологические обрастания представляют собой совокупность микроорганизмов поселившихся и развивающихся в воде, на теплообменной поверхности оборудования, в трубопроводе, и на железобетонных конструкциях охладителей воды.Эти обрастания образуются вследствие заражения воды М.О. и благоприятных условий для их размножения, а именно температурой воды от 15 до 45 градусов Цельсия, присутствием в воде питательных веществ и содержания растворенного кислорода.
Биологические загрязнения обычно представлены тремя группами:
Водоросли; бактерии, молюски.
Для уничтожения и предотвращения развития биообрастаний необходимо производить реагентную обработку. В качестве реагентов применяю биоциды как неокисляющего типа, так и биоциды окисляющего типа.
Неокисляющие Биоциды
2,2-Дибромо-3-нитрилопропионамид (DBNPA) - биоцид быстрого уничтожения, который легко гидролизуется как в кислой, так и в щелочной среде. Он предпочтителен из-за своей нестабильности в воде, поскольку быстро убивает, а затем быстро разлагается, образуя ряд продуктов, в зависимости от условий, включая аммиак , ионы бромида , дибромацетонитрил и дибромуксусную кислоту . DBNPA взаимодействуя с обменом веществ и клеточной структурой.Изотиазолиноны
Биоциды на основе изотиазолинонов широкого спектра действия (универсальные) для контроля содержания бактерий, грибка и водорослей в промышленных системах водоснабжения, таких как оборотные системы охлаждения, пастеризаторы, системы воздухоочистки, эмульсии полимеров и адгезивы. Изотиазолиноны представлены двумя производными: 5-хлор-2-метил-4-изотиазолин-3-он (CMI, метилхлоризотиазолинон) и 2-метил-4-изотиазолин-3-он (MI, метилизотиазолинон). Бактерицидный эффект изотиазолинона достигается путем разрыва связи между бактерией и протеином водорослей. При контакте с микробами изотиазолиноны эффективно сдерживают их рост, что приводит к гибели микробов. Они обладают сильными ингибирующими и биоцидными свойствами по отношению к обычным бактериям, грибам и водорослям. В числе основных преимуществ можно выделить высокую биоцидную эффективность, отсутствие остаточного продукта, безопасность в эксплуатации, хорошая совместимость, хорошая стабилизация, низкая стоимость в эксплуатации.
Глутаровый альдегид
Это быстродействующий биоцид ( от 3 до 4 часов, или от 4 до 6 часов при наличии сложных обрастаний), неионный, не образующий пены.
Эффективен в широком диапазоне pH (обычно от 6,5 до 9,0) и совместим с хлором. Эффективно воздействует на биопленки и сульфатредуцирующие бактерии. Данный биоцид эффективен особо, если есть риск появления Legionella. Период жизни глутарового альдегида короткий, зависящий от параметров охлаждающей воды, но, обычно составляет от 4 до 12 часов. Его применение в больших, протяженных системах, может быть экономически необоснованным. Не действует на грибки и водоросли.
Четвертичные аммониевые соединения (ЧАС) - являются одними из самых часто используемых дезинфицирующих средств. Их низкая токсичность и возможность модифицирования для различных применений и в отношении различных микроорганизмов способствует их широкому распространению. Четвертичные аммониевые соединения используются как вещества-дезинфектанты для борьбы со многими бактериями. Это обусловлено их свойствами как поверхностно-активных антисептических веществ. Воздействуя на микроорганизмы, четвертичные аммониевые соединения оказывают неблагоприятное влияние на их клетки. При малых концентрациях ЧАС влияют на способность к делению и размножению патогенных микроорганизмов, при достаточной концентрации ЧАС вызывают их гибель. При работе с ЧАС обязательно следует учитывать, что проведенные исследования показали обязательную концентрацию рабочего раствора 0,5-1 %. Если концентрация активного вещества будет меньше, то это, скорее всего, вызовет привыкание бактерий к воздействию ЧАС, что чревато усугублением эпидемиологической ситуации по месту. - Читайте подробнее на
Полигуанидины - Полигексаметиленгуанидин (ПГМГ) - производное гуанидина, в основном используемого в качестве биоцидного дезинфектанта,
Исследования показали, что раствор ПГМГ проявляет свойства фунгицида и бактерицида (антибиотика), активность в отношении и грамотрицательных и грамположительных бактерий.
Это вещество имеет моющие, анти-коррозионные и флокулирующие свойства и эффективно против биоплёнок.
Полигуанидины - класс малотоксичных дезсредств пролонгированного действия.. Предварительные выводы указывают на то, что ПГМГ и его производные, в первую очередь наносят повреждения клеточным мембранам путём подавления активности клеточного фермента.
THPS (TKHPS) (Гидроксиметил (тетракис) фосфония сульфат
THPS –биоциды относятся к алкилфософоновым группам. Это уже более новая группа биоцидов, которые безопасны для окружающей среды. Они действуют в широком диапазоне pH и могут применяться как в закрытых, так и в открытых системах охлаждения. Эффективен против сульфатредуцирующих бактерий.
Имеет ограниченную активность против водорослей и биопленок в сильно загрязненных системах.
THPS –биоциды катионоактивны и если их применять в высоких концентрациях, то существует риск несовместимости с анионоактивными ингибиторами (полиакрилаты, полималеиновая кислота (PMA) и фосфонаты).
Эти биоциды менее опасны, чем большинство применяемых сегодня. Особенно экономически обоснованным является их применение в неболтших системах охлаждения.
Окисляющие биоциды.
Водный раствор гипохлорита натрия - сильный окислитель. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве.Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода.
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора.
При температуре 70 °C разложение безводного гипохлорита протекает со взрывом.
Надуксусная кислота СН3С(О)ООН - Средство представляет собой, водно-уксусный раствор надуксусной кислоты СН3С(О)О-ОН(стабилизированный ). Надуксусная кислота СН3С(О)ООН — мощное дезинфицирующее средство с высоким окислительным действием, с большим диапазоном рабочих температур от 0 до 40 °C , и широких значений рН от 3.0 до 7.5, бесцветная, прозрачная жидкость, полностью растворимая в воде с резким характерным запахом.
Преимущества и проблемы с использованием Перуксусной кислоты (СН3СО3Н).
У Перуксусной кислоты есть несколько преимуществ перед обычными дезинфекционными технологиями, такими как хлорирование или применение Ультрафиолета. Эффективность Перуксусной кислоты высока в широком диапазоне рН и не подвержена влиянию высоких концентраций нитрита или низкого содержания аммиака, которые могут колебаться во время обработки. Добавление Перуксусной кислоты Не увеличивает концентрацию хлора сточных вод. Перуксусная кислота устойчива при хранении до года без снижения качества, что делает ее выгодным в применении.К недостаткам применения перуксусной кислоты можно отнести:
- содержание уксусной кислоты, в результате может увеличиться биохимическая потребность кислорода в сточной воде. Стоимость Перуксусной кислоты выше, чем гипохлорит натрия, хотя при не равных значениях дозы все нивелируется. Недоработан метод измерения остаточной концентрации перуксусной кислоты, сейчас концентрация перуксусной кислоты определяется тем же методом, что и для общего остаточного хлора.
Перекись водорода Н2O2. — это прозрачная слегка вязкая бесцветная (в больших объемах — чуть синеватая) жидкость. Она в 1,5 раза тяжелее воды и смешивается с ней в любых соотношениях.
Н2О2 относят к специфической группе веществ — активным формам кислорода. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение с неспаренным электроном на внешнем электронном уровне. Перекись легко распадается на атомарный кислород и воду. При этом она действует как агрессивный окислитель, повреждающий белки клеточных мембран микроорганизмов, инактивируя ферменты и вмешиваясь в процессы обмена веществ.
В концентрации 0,001–0,1% при комнатной температуре перекись угнетает рост микроорганизмов, а в концентрации 0,1% и выше действует как бактерицид/фунгицид.